Tento typ dotazů dostávám velmi často a také, zda jsou probiotika vhodná podávat dětem už od narození. Odpověď je komplexnější a vždy individuální, proto doporučuji se o vhodnosti konkrétních probiotik vždy poradit s odborníkem, který této problematice rozumí.
Pojďme si nejprve popsat, co střevní mikrobiom plodu, potažmo novorozence ovlivňuje, jak se zhruba vyvíjí (z dosavadních poznatků, které máme) a jaké konkrétní probiotické kmeny můžeme využít v případě určitého zdravotního problému (viz tabulka níže).
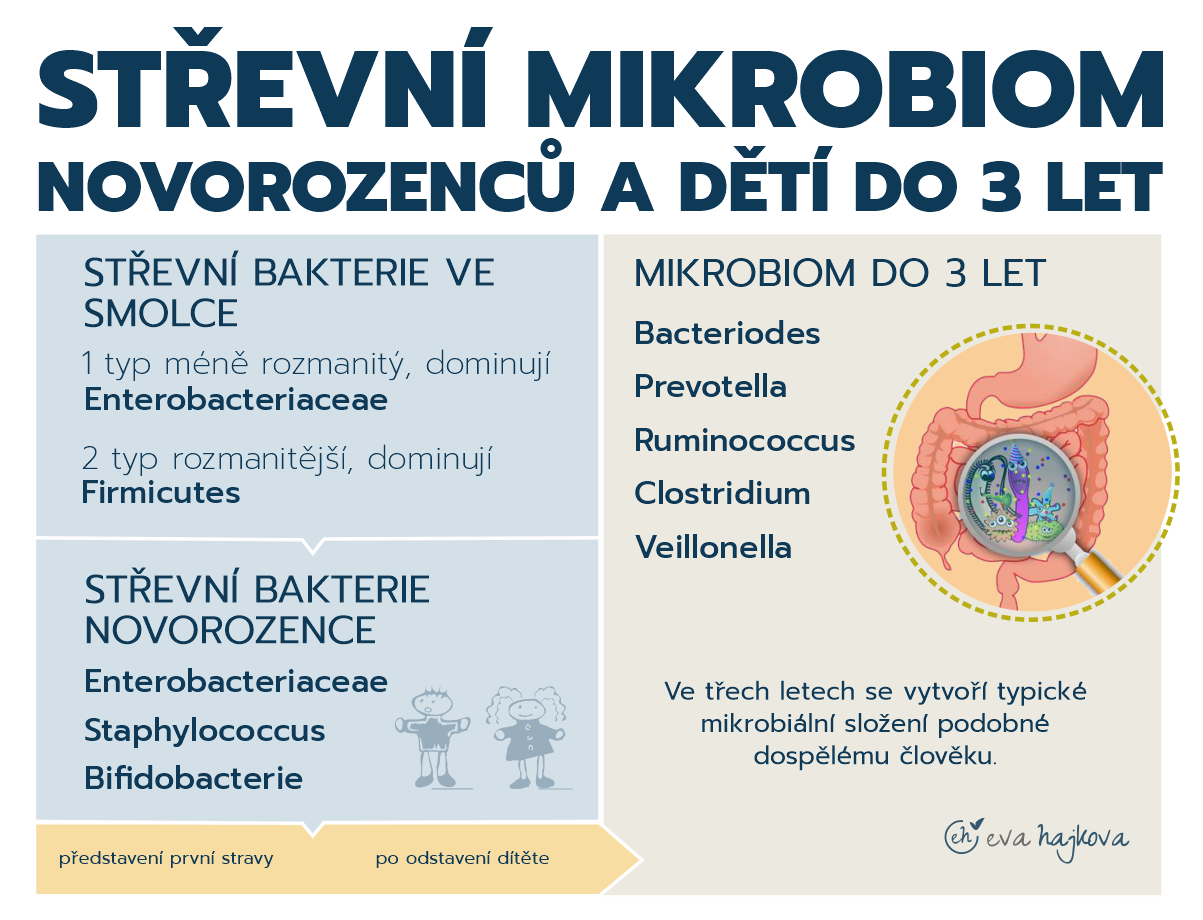
Trávící trakt nenarozeného dítěte (plodu) byl ještě před nedávnem považován za sterilní, dokud nebyl kolonizován mikroorganismy z okolního prostředí a matčinou vaginální a kožní mikrobiotou a to až po porodu. Nedávné studie však zjistily přítomnost mikroorganismů v plodové vodě, plodových membránách, pupeční šňůře, placentě a ve smolce. Gosalbes etal. ukázal, že mikrobiální složení smolky lze rozdělit do dvou typů: první typ je méně rozmanitý a dominují bakterie kmene Enterobacteriaceae, a druhý typ je rozmanitější a dominují bakterie kmene Firmicutes, a to zejména bakteriemi mléčného kvašení. Toto mikrobiální složení se liší od mikrobiálního složení vagíny, fekálií nebo kůže těhotných žen, a připomíná mikrobiální složení plodové vody, což naznačuje, že bakterie ve smolce pocházejí z dělohy matky.
Po narození dominují především Enterobacteriaceae (např. e.coli) a Staphylococcus. Po nich pak dominuje Bifidobacterie a některé bakterie mléčného kvašení. Mikroflóra odvozená od Bifidobacterie, zvaná „Bifidus flóra“, se udržuje až do představení první stravy. Po odstavení dítěte od mateřského mléka je Bifidus flóra zastoupena mikroorganismy, které představují hlavně bakterie z rodů Bacteriodes, Prevotella, Ruminococcus, Clostridium a Veillonella.
Nakonec, asi ve třech letech, se vytvoří typické mikrobiální složení podobné dospělému člověku.

Jak se liší mikroflóra novorozenců narozených přirozeně vs císařským řezem
U novorozenců porozených vaginálně se střevní mikroflóra podobá vaginální mikroflóře jejich matek. Dominují Lactobacillus, Prevotella nebo Sneathia, zatímco mikroflóra dětí narozených císařským řezem jsou nejvíce podobné mikroflóře kůže matky, které dominuje Staphylococcus, Corynebasterium a Propionibacterium. Kromě toho, některé studie ukázaly, že kolonizaci Bacteriodes a Bifidobacterium je zpožděna o jeden měsíc po narození. Nedostatečné zastoupení bakterií bylo také pozorováno v mikroflóře kojenců narozených císařským řezem tři až čtyři měsíce po narození. Stejné studie navíc ukázaly, že kojenci narození císařským řezem měli zvláště nízkou bakteriální rozmanitost. U dětí narozených císařským řezem bylo navíc pozorováno zvýšené riziko imunitních poruch, jako je např. alergická rýma, astma a celiakie.
Přehled probiotických kmenů a jejich význam u novorozenců
Laktobacily:
L. rhamnosus – hraje důležitou roli při „zrání“ imunitního systému novorozence. Konkrétně L.rhamnosus GG (ATCC 53103) je patentovaný podkmen L.rhamnosus znám také pod Culturelle.
L.casei – pomáhá imunitnímu systému rozpoznat nebezpečnými toxiny a patogeny od bezpečných antigenů. L.casei zvyšuje IgA a je zahrnutý v procesech trávení lepku a mléčných produktů.
L.paracasei – může efektivně chránit před rotaviry, Staphylococcus aureus a clostridium difficile.
L. gasseri – najdeme v mateřském mléce a produkuje bakteriocidní inhibitory proti Clostridium, Listerii a Enteroccocus.
L. salivarius – pomáhá kolonizovat trávící trakt, zvyšuje absorpci vápníku a napomáhá udržovat správnou funkci bariéry trávícího traktu.
L. reuteri – chrání před kolikou, průjmy, respiračními infekcemi a ukázalo se, že pomáhá redukovat incidenci ADHD a úzkostí u dětí.
Bifidobakterie:
B. infantis – je nejvíce se vyskytující se kmen u novorozenců a s přibývajícím věkem množství klesá. Snižuje riziko nekrotizující enterokolitidy u předčasně narozených dětí a dětí s nízkou porodní váhou.
B. lactis (znám také jako B animalis subsp.lactis) – zvyšuje normální funkce imunitního systému tím, že zvyšuje množství T pomocných buněk a odpověď IgA na toxiny.
B. bifidum – je jedním z prvních kmenů kolonizující GIT novorozence a lépe ulpívá na stěně střeva než jiné kmeny. Supresuje IgE sekreci a množství je mnohdy nižší u novorozenců s alergiemi. Efektivně snižuje novorozenecké ekzémy, zácpy a průjmy.
B. longum – reguluje imunitní odpověď antigenů respirační imunity.
B. breve – působí proti rotavirům a redukuje populaci anaerobních bacteriodes a clostridium ve střevě.

Klinické příznaky novorozenců a malých dětí, které se MOHOU zlepšit po užití konkrétních probiotických kmenů.
| Zdravotní problém | Možný přínos probiotik | Probiotický kmen | Dávka |
| Kolika
(definovaná jako pláč, trvající ≥3 hodiny denně po dobu ≥3 dny v týdnu) |
Mohou zabránit anebo omezit kolikové stavy u novorozenců, kteří jsou exkluzivně kojeni v prvních 3 měsících života. |
Lactobacillus reuteri DSM 17938 (např. Bio Gaia) |
1 x 108 (100 milionů) (cfu)/den Lactobacillus reuteri DSM 17938 |
|
Průjem spojený s užíváním antibiotik (ATB) |
Mohou zabránit průjmu spojeného s užíváním ATB |
Lactobacillus rhamnosus GG (LGG)
nebo Saccharomyces boulardii |
1 x 1010 – 2 x 1010 (10 –
20 miliard) cfu/den LGG
250 mg-500 mg/den Saccharomyces boulardii |
|
Akutní gastroenteritida (průjem) |
Mohou zredukovat dobu průjmu o cca 1 den (společně s řádnou hydratací) |
Lactobacillus rhamnosus GG (LGG
nebo Saccharomyces boulardii |
1 x 1010 (10 miliard) cfu/den LGG
250 mg – 750 mg/den Saccharomyces boulardii |
A co z toho všeho plyne?
Dle aktuálních dat, které máme víme, že střevní mikroflóra plodu není sterilní, jak se v minulosti tvrdilo. Rozmanitost a složení baktérií se liší u novorozenců, narozených přirozeným způsobem (je rozmanitější) než u novorozenců narozených císařským řezem. Obecně střevní mikrobiom novorozenců ovlivňuje mnoho faktorů, které jsou především spojené se zdravím a mikrobiálním prostředím matky a zda je dítě kojeno či nikoli.
Abychom mohli probiotikum považovat v dané klinické situaci za skutečně účinné, musí být jeho efekt podpořen kvalitními vědeckými studiemi, což bohužel zatím ve většině případů nemáme. I proto nelze probiotika doporučovat všem novorozencům a dětem! Vždy je potřeba pečlivě zkoumat složení a dávku konkrétního výrobku. Probiotika běžně nepředstavují pro novorozence a děti žádné riziko, každopádně výšené opatrnosti je třeba dbát u dětí s oslabeným imunitním systémem, u nedonošenců apod.
Doporučení k užívání probiotik, probiotik a synbiotik se liší země od země, dle aktuální legislativy. Například v Kanadě se sach.b a LGG nepodává do jednoho roku věku apod.
Zde si můžete přečíst stanovisko České pediatrické společnosti k problematice probiotik a jejich doporučení v rámci jejich pracovní skupiny: https://www.gigalekarna.cz/downloads/stanovisko-k-probiotikum-2014.pdf
Zdroje:
https://www.sciencedirect.com/topics/medicine-and-dentistry/amnion-fluid
https://www.sciencedirect.com/topics/medicine-and-dentistry/fetal-membrane
Pannaraj,Pia S,M.D.,MPH, Li F, PhD., Cerini C, M.D. et al. Association betwen breast milk bacterial communities and establishment and development of the infant gut microbiom. JAMA Pediatrics. 2017, 171 (7):647
https://www.sciencedirect.com/science/article/pii/S1323893017301119
https://www.intechopen.com/books/probiotics/usefulness-of-probiotics-for-neonates-
Harb T, Matsuyama M, David M, Hill RJ. Infant colic – what works: a systematic review of interventions for breast-fed infants. JPGN. 2016;62(5):668-86
Indrio F, Di Mauro A, Riezzo G, Civardi E, Intini C, Corvaglia L, et al. Prophylactic use of a probiotic in the prevention of colic, regurgitation, and functional constipation. A randomized clinical trial. JAMA pediatr. 2014;168(3):228-233
Savino F, Ceratto S, Poggi E, Cartosio ME, di Montezemolo LC, Giannattasio A. Preventive effects of oral probiotic on infantile colic: a prospective, randomized, blinded, controlled trial using lactobacillus reuteri DSM 17938.
Benef Microbes. 2015;6(3):245-51
Szajewska H, Canani RB, Guarino A, Hojsak I, Indrio F, Kolacek S, et al. Probiotics for the prevention of antibiotic- associated diarrhea in children. JPGN. 2016;62(3):495-506.